דופמין (DOPAMINE)
כותב המאמר: פרופסור לאון גרינהאוס
דופמין הינו מוליך עצבי מרכזי במערכת העצבים המרכזית של האדם. הוא משחק תפקיד חיוני במספר רב של פעילויות בקרה מוחיות. פעילויות כמו: תנועות מוטוריות, העולם הרגשי, המוטיבציה, מערכת התגמול (reward system), הפרשה של הורמון פרולפטין, במחזור הנשי ובתפקוד מיני. הפרעות במערכת של דופמין באות לידי ביטוי בעיקר במצבי חולי כמו מחלת פרקינסון, סכיזופרניה, דיכאון, התמכרויות והפרעת קשב וריכוז.
מהו התפקיד של דופמין במערכת העצבים המרכזית?
מוח האדם כולל מאות מיליוני תאים הנקראים תאי עצב. במהלך התפתחות המוח, תאי עצב מתארגנים במרכזים ייחודיים האחראים על התפקודים הרבים והשונים של מוח האדם. כדי לתאם פעילות בין תאי העצב ובין המרכזים השונים במוח, יש צורך בקומוניקציה-"דיבור"- בין התאים. הבעת דעה לדוגמא, מצריכה תיאום בין מרכזי דיבור שיבחרו את המילים הנכונות ויארגנו משפטים מתאימים, לבין מרכזי זיכרון שיארגנו את רצף המחשבות המסבירות את אשר רוצים להגיד לבין מרכזי רגש המעורבים בהבעה רגשית של הרעיון. הוא הינו אחד מהמוליכים העצביים המאפשרים ומווסתים את הקומוניקציה בין המרכזים של תאי עצב.
המוח מורכב מחומר אפור וחומר לבן. בחומר האפור נמצאים תאי העצב ובחומר הלבן נמצאים הסיבים שיוצאים מתאי עצב ומחברים בין תאים באזורים שונים של המוח ובהמשך גם עם יתר הגוף. התאים שיוצרים דופמין מרוכזים במרכז המוח בצורה של גרעיני תאים. מתאים אלו יוצאים שני סוגים של סיבים הנקראים דנדריטים ואקסונים. הדנדריטים מחברים בין תאים של אותו אזור. האקסונים מתארגנים למסלולים המחברים בין הגרעינים של דופמין לבין תאי עצב באזורים רחוקים יותר. במוח מוכרים 4 מסלולים גדולים של אקסונים הקשורים לתפקוד דופמין. נתייחס למסלולים אלו ולתפקידם כאשר נרחיב על המחלות הנובעות מתפקוד לקוי של דופמין במוח.
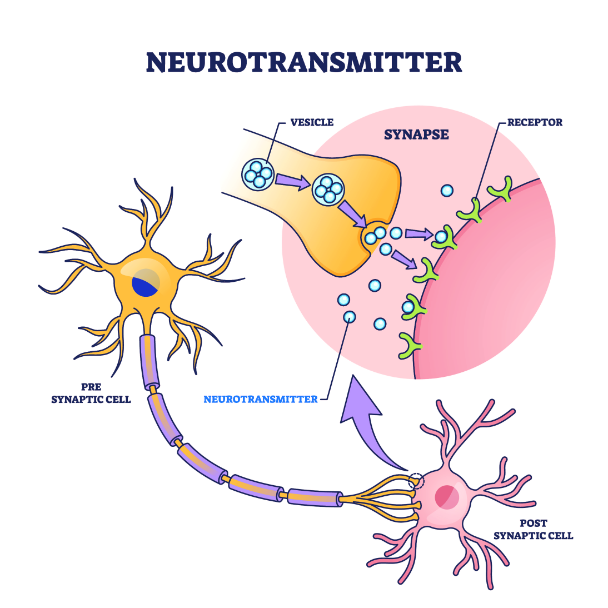
הסיבים הלבנים (האקסונים) מתחברים לגרעיני התאים דרך חיבור מיוחד בשם סינפסה (SYNAPSE). חיבור זה מכיל ממברנה מיוחדת שבה נמצאים קולטנים שונים של דופמין. הוא מופרש לתוך הסינפסה מהקצה הקרוב של האקסונים ונקשר לקולטנים ספציפיים בתאי עצב המשך. קולטני דופמין הם רבים ומוכרים מ D1 עד D5. כל סוג קולטן ממלא תפקיד שונה במוח.
הסינפסה הינה חיבור דינמי. דופמין המופרש בתא הראשוני (פרה סינפטי) מפעיל את תאי ההמשך (פוסט סינפטי) וכך נוצרת שרשרת הפעולה האלקטרוכימית במוח. אי אפשר להפעיל את התאים ללא הפסקה, לכן פעילות הדופמין נפסקת כעבור זמן מה. שיבושים במנגנון הוויסות של דופמין יכול להוביל למחלות. לדוגמא, בסכיזופרניה, קיים עודף פעילות של דופמין. לעומת זאת, במחלת פרקינסון תאים של דופמין באזור בשם החומר השחור (substantia nigra) מתנוונים, וכך נוצר חוסר באזורים רבים במוח.
המושגים בעברית של התמונה המצורפת הן:
- מוליך עצבי (NEUROTRANSMITTER)
- סינפסה (SYNAPSE)
- שלפוחית סינפטית (VESICLE)
- קולטן (RECEPTOR)
- מוליך עצבי דופמין (NEUROTRANSMITTER)
- תא פרה סינפטי (PRESYNAPTIC CELL)
- תא פוסט סינפטי (POSTSYNAPTIC CELL)
מסלולי דופמין במוח האדם
במערכת העצבים המרכזית, דופמין מיוצר בגרעינים הנמצאים באזורים עמוקים של המוח. מגרעינים אלו יוצאים אקסונים המובילים אותו לאזורים נרחבים של המוח. אקסונים אלו מרוכזים בארבעה מסלולים מרכזיים:
- מסלול של גרעינים המעורבים במחלת הפרקינסון ובסכיזופרניה (מסלול זה נקרא ניגרו סטריאטלי).
- מסלול של הפרשת הורמון הפרולקטין (מסלול המגיע לבלוטת יותרת המוח).
- מסלול ההנאה (מסלול בשם מזו לימבי)
- מסלול החשיבה (המגיע לקליפת המוח ונקרא מזו קורטיקל).
- ישנה גם מערכת דופמין ברשתית של העין
הפרעות בתפקוד דופמין ומחלות
הקשר בין חוסר דופמין למחלת הפרקינסון. הטיפול בעזרת דופמין.
מחלת פרקינסון הינה מחלה ניוונית (דגנרטיבית) של המוח המאופיינת בהפרעות מוטוריות. מחלה זו גורמת לנוקשות שרירים, לאיטיות, לרעידות של הגפיים ולחוסר יציבות. תחילת המחלה מופיעה בשנות החמישים של החיים. הסיבות למחלה הן אידיופטיות (לא ידועות) אם כי יש מקרים המופיעים לאחר חבלת ראש, זיהומים של המוח או אחרי הרעלות. מחלת פרקינסון מתקדמת באיטיות, נוטה להחמיר עם השנים ולפעמים מתקדמת עד להופעת שיטיון ומוות.
הקשר בין ניוון של תאי דופמין באזור הנקרא החומר השחור (substantia nigra) לירידה בכמות הדופמין באזורים של בקרה על תנועות מוטוריות הוכח כבר בשנות ה60 של המאה הקודמת. באותה תקופה החלו ניסויים לטיפול במחלת פרקינסון עם דופמין שניתן בצורה של כדורים. עד היום הטיפול במחלת פרקינסון מבוסס על מתן תכשירים הקשורים לדופמין או תכשירים הפועלים על קולטני דופמין.
הקשר בין עודף דופמין לסכיזופרניה ולמצבים פסיכוטיים אחרים.
סכיזופרניה הינה מחלה קשה הפוגעת בו זמנית בחשיבת האדם, בעולמו הרגשי, בתפקודו ובאיכות החיים שלו. המאפיינים המרכזיים של המחלה הם:
- הפרעות בחשיבה בצורה של מחשבות לא מציאותיות.
- הפרעות בתפיסה בצורה של הלוצינציות (הזיות). לדוגמא, שמיעת קולות שרק אותו אדם שומע.
- הפרעות התנהגות בצורה של אי שקט משמעותי או תוקפנות.
- האטה מוטורית עד כדי הפסקת פעילות (קטטוניה).
השכיחות של סכיזופרניה זהה בין גברים לנשים. המחלה מתחילה בדרך כלל בגילאי 15-25. התפתחות המחלה יכולה להיות איטית עם התפתחות הדרגתית בגילאי התבגרות מוקדמים, או מהירה עם הופעת התקף פסיכוטי. לרוב ההתקף הפסיכוטי מתפרץ תוך מספר ימים עד מספר שבועות. התקף פסיכוטי מאופיין בין היתר, בשמיעת קולות (הלוצינציות), הפרעות בחשיבה (דלוזיות מצורות שונות) והפרעות התנהגותיות (תוקפנות, אי שקט). משבר פסיכוטי חריף הוא קריטריון בל יעבור לאבחון סכיזופרניה.
למרות התקדמות גדולה בהבנת המחלה, הסיבות לסכיזופרניה טרם ידועות. מקובל לחשוב שלסכיזופרניה סיבות שונות, גנטיות, נוירו התפתחותיות, סביבתיות ומשפחתיות.
הטיפול בסכיזופרניה עם תרופות נוגדות דופמין
הטיפול בסכיזופרניה התפתח מאוד במהלך השנים וכולל היום טיפול תרופתי, טיפול חינוכי, טיפול שיקומי ואף טיפול משפחתי. יש כיום תרופות רבות שעוזרות לטיפול, במיוחד בטיפול של המשבר הפסיכוטי החריף. הטיפול התרופתי הקיים היום הוא פחות יעיל עבור הסימנים השליליים של המחלה.
הטיפול התרופתי המודרני לסכיזופרניה החל בשנות ה60 של המאה הקודמת, לאחר שהוכח שתרופה בשם כלורופרומזין יעילה בטיפול של משבר פסיכוטי. מחקרים הראו שהשפעת התרופה מתבססת על חסימת קולטני דופמין מסוג D2 באזור הסטריאטום במוח. המחשבה הזאת הובילה להתפתחות ההיפותזה הדופמינרגית הטוענת שבסכיזופרניה קיים עודף פעילות דופמין באזור הסטריאטום.
כל התרופות בשימוש בטיפול של סכיזופרניה משפיעות על קולטני דופמין. הדור הראשון של התרופות פעל על קולטני דופמין D2. בשנים האחרונות נוספו תרופות המשפיעות בו זמנית על קולטני דופמין שונים ועל קולטנים של מוליכים אחרים במוח. מוליכים כמו סרוטונין, גאבא, אצטילכולין, גלוטמט, ועוד. סביר להניח שתובנות חדשות על הסיבות לסכיזופרניה יובילו לתרופות חדשות, לתגליות על הצורות השונות של המחלה ועל טיפולים ספציפיים יותר.
התפקיד הכפול של דופמין בדיכאון קליני
המוליכים העצביים סרוטונין ונוראפינפרין נחשבים כמעורבים מרכזיים במצבים קליניים של דיכאון. בשנים האחרונות מצטרף דופמין למוליכים העצביים החשובים בדיכאון. בכתיבה הפופולרית, הוא נחשב ל"הורמון האושר" עקב מעורבותו בחיי הרגש של האדם. לדופמין תפקיד מרכזי באיזון מצבי רוח, בעידוד המוטיבציה ובהפעלת מערכת התגמול- REWARD SYSTEM. מחקרים הראו שדופמין פעיל במרכזי עונג ומוביל לתחושות של הנאה, מוטיבציה ושביעות רצון. חוסר איזון במערכת הדופמינרגית יכול להסביר סימפטומים מרכזיים של דיכאון, סימפטומים כמו אנהדוניה (חוסר הנאה וחוסר עניין), מוטיבציה ירודה והאטה פסיכומוטורית.
כפי שנאמר קודם, המערכת הדופמינרגית מתחילה בגרעינים יוצרי דופמין שנמצאים עמוק במוח. הוא מובל בעזרת תהליך ביולוגי מורכב, במסלולים של אקסונים (המסלול המזולימבי) עד לאזור בשם המערכת הלימבית- LIMBIC SYSTEM. האזור הלימבי אחראי על חיי הרגש של האדם והוא מופעל באופן שלילי במצבי דיכאון. מסלול נוסף של דופמין הוא המסלול המזוקורטיקלי אשר מגיע לקליפת המוח ומעורב בהפעלת תפקודים ניהוליים (תפקודים כמו תכנון, בחירה, חשיבה אבסטרקטית ועוד). תפקוד לא תקין של מסלולים אלו יכול להסביר חלק ניכר של הסימפטומים של דיכאון קליני.
בין 30-50% של מטופלים הסובלים מדיכאון קליני לא מגיבים מספיק טוב לטיפול הראשוני של הדיכאון. טיפול ראשוני זה כולל בדרך כלל תרופות הפועלות על קולטני סרוטונין ועל קולטני נוראפינפרין. אחת מהשיטות המקובלות היום לטיפול בדיכאון שמגיב לאט לטיפול-דיכאון הנקרא דיכאון עמיד- הינה לשלב תרופה שחוסמת את הפעילות של דופמין לטיפול עם תרופה נוגדת דיכאון. תרופות אלו הן אותן תרופות בשימוש בטיפול במצבים פסיכוטיים. המחשבה מאחורי שימוש בשתי תרופות אלו, תרופה נוגדת דיכאון ותרופה החוסמת את פעילות קולטני דופמין, מבוססת על עדויות מחקריות המראות פעילות דופמינרגית מופרזת במצבי דיכאון.
שימוש בתרופות מחזקות קולטני דופמין בדיכאון קליני
פרופסור גרינהאוס בעבודתו הקלינית מעלה אופציה נוספת בטיפול של דיכאון עמיד. במצבים של דיכאון מאוד עמיד, מצב הנקרא עמידות דרגה 4 (המטופל לא הגיב לשילובים תרופתיים וגם לא לטיפול בחשמל-ECT או לטיפול בגרייה מגנטית), קיימת פעילות נמוכה של דופמין. לפיכך הוא ממליץ על טיפול בתרופות המעלות את רמת הדופמין בשילוב עם תרופות נוגדות דיכאון רגילות. מתן תרופות המעודדות את תפקוד קולטני הדופמין מסייע לטיפול של מקרים מאוד עמידים אלו.
דופמין והתמכרויות
ההתמכרויות לחומרים כימיים הן רבות מאוד. טווח החומרים אליהם האדם יכול להתמכר כולל אלכוהול, קנאביס, קוקאין, אופיאטים, MDMA, פטריות הזייה, עישון, תרופות הרגעה ותרופות שינה, סטימולנטים והרבה מאוד חומרים נוספים. יש לציין שכל הזמן נוצרים באופן חוקי ולא חוקי חומרים עם פוטנציאל להיות ממכרים. תעשיית הסמים מגלגלת כספים רבים ומעורבת עם עולם הפשע.
בנוסף לחומרים כימיים, ישנן התנהגויות שכאשר הן מוגזמות ופוגעות באיכות החיים של האדם, הן נחשבות להתמכרות. פעילויות כמו עישון רב, צפייה רבה בפורנוגרפיה, שימוש מוגזם באינטרנט, פעילות מינית מוגזמת, עיסוק רב בקניות, הימורים כפייתיים ועוד.
בהתמכרויות אנו עדים לאינטראקציה בין תכונות אישיות של האדם והשפעה נוירו-ביולוגית של החומר הכימי או של ההתנהגות. קיים גורם התנהגותי משותף לכולן והוא היכולת של החומר או של ההתנהגות להפעיל מרכזי תגמול- REWARD SYSTEM במוח האדם.
הרבה מהדוגמאות שנתתי, גם של החומרים הכימיים וגם של ההתנהגות, יכולות להיחשב כנורמטיביות ורגילות. מתי זה נחשב להתמכרות? הגדרת התמכרות לפי ה- DSM-5, ספר האבחנות של האיגוד הפסיכיאטרי האמריקאי, קובעת שבהתמכרויות ישנו אשכול (אוסף, מקבץ) סימפטומים פסיכולוגיים, התנהגותיים וקוגניטיביים המצביעים על כך שהאדם ממשיך להשתמש בחומרים או ממשיך להתנהג בצורה מסוימת למרות שהוא מודע לכך שההתמכרות פוגעת בניהול תקין של החיים. למרות שהאדם המכור יודע שעליו להימנע הוא לא מצליח לעמוד בדחף להתמכרות (כמיהה לחומר או להתנהגות).
הפעלת מרכז התגמול גורם לתחושת הנאה ועונג הנעימים לאדם. עם זאת, הפעלה חוזרת מובילה להתפתחות של סבילות- TOLERANCE-לחומר או להתנהגות. כלומר, כדי לקבל את אותה ההשפעה, על האדם לחזור לשימוש רב יותר כל פעם. כמיהה לחומר הינו גורם מרכזי בדרבון ההתמכרות.
דופמין הינו מוליך עצבי חשוב בהפעלת מערכת התגמול-REWARD SYSTEM , מערכת האמונה על תחושות נעימות כפי שכתבתי קודם. חומרים כימיים או התנהגותיות הגורמות להפרשת יתר של דופמין במערכת התגמול יכולים להוביל להתמכרות. הפרשת יתר של דופמין יכולה לגרום לתחושת הנאה ואופוריה, דבר המעודד שימוש יתר ושימוש חזרתי. השימוש החוזר של החומר גורם לכך שהמוח יפתח סבילות ויגיב פחות לדופמין המופרש. הרצון לקבל את אותה עוצמת ריגוש, מביא לשימוש חוזר של החומר או לחזרה של ההתנהגות אבל בעוצמה ותדירות גבוהים יותר.
מסלולי דופמין שמעורבים בהתמכרויות הם אותם המסלולים הקשורים להתפתחות דיכאון. לא ידוע מדוע אדם מסוים מתמכר ואחר מפתח דיכאון. ידוע אומנם שלעיתים קרובות יש הופעה משולבת של דיכאון עם התמכרות.
דופמין והפרעת קשב וריכוז-ADHD
מצב קליני נוסף בו קיימת חשיבות לתפקוד של מערכת דופמינרגית הינו הפרעת קשב וריכוז-ADHD. הפרעה זאת נחשבת תולדה מתפקוד דופמינרגי מוקטן, לכן השימוש של תרופות סטימולנטיות כמו ריטלין, אטנט או ויואנס מפעילות את מערכת הדופמין.
יש מספר סוגים של ADHD. מטופלים יכולים לדווח על 3 מצבים. מצב של ריכוז נמוך, מצב של היפראקטיביות ומצב מעורב (סימנים של הפרעה בריכוז ביחד עם היפראקטיביות). מחקרים מצביעים על כך שבהפרעת קשב וריכוז קיים תפקוד לא תקין של המערכת הדופמינרגית. הפרעה תפקודית זו קשורה לרמות נמוכות של דופמין במוח או להפרעות בהולכה במסלולים דופמינרגיים.
הפרעת קשב וריכוז נחשבת להפרעה של ילדים ובני נוער. עד 80% מהמקרים המאובחנים משתפרים עם מעבר השנים, עם או בלי עזרה טיפולית. עם זאת, כ 20% של הסובלים מ ADHD ימשיכו לדווח על סימפטומים גם בגילאים מבוגרים יותר.
טיפול בהפרעת קשב וריכוז עם תרופות מחזקות דופמין
הטיפול התרופתי המוביל בהפרעת קשב וריכוז מתבסס על תרופות הפועלות על המערכת הדופמינרגית. תרופות אלו הם מתילפנידאט (ריטלין בצורותיו השונות) ואמפטמינים (אטנט וויואנס). משתמשים גם בתרופות הפועלות על מוליך עצבי אחר בשם נוראפינפרין. יש צורך במעקב רפואי מאחר ותרופות סטימולנטיות יכולות לגרום לתופעות לוואי וגם להתמכרות כפי שכתבתי בחלק הקודם. בנוסף להתמכרות, שימוש יתר של תרופות סטימולנטיות יכול להוביל למצבים קליניים של הפרעות שינה, ירידה במשקל ותופעות של חרדה. במקרים חריגים שימוש יתר של סטימולנטים יכול להוביל למצבים תוקפניים ואף לפסיכוזה.
סיכום
דופמין הינו מוליך עצבי מרכזי במוח האדם. הוא מעורב בשורה ארוכה של תפקודים כמו מערכות החשיבה, הרגשות, המוטיבציה וההנאה. הוא מסונתז בגרעינים עמוקים במוח והוא מובל לאזורים שונים דרך מסלולים של חומר לבן (מורכבים מאקסונים). הפרעות בתפקוד של תאי העצב המסנתזים דופמין או במסלולים המובילים את הדופמין (מערכת דופמינרגית), יכולים להוביל לתסמונות קליניות, נוירולוגיות ופסיכיאטריות . התסמונת הנוירולוגית המרכזית שמופיעה כאשר תאי העצב של הדופמין נהרסות הינה מחלת הפרקינסון. תסמונות פסיכיאטריות הקשורות להפרעות במערכת הדופמינרגית כוללות סכיזופרניה ומצבים פסיכוטיים, תסמונת של דיכאון מג'ורי, התמכרויות והפרעות קשב וריכוז.

 כותב המאמר:
כותב המאמר: